第一类医疗器械出口销售证明办理流程与要求详解

随着全球医疗器械贸易的日益频繁,我国生产的医疗器械产品在国际市场上的需求不断增长。对于风险程度较低、实行常规管理的第一类医疗器械,其出口销售证明的办理是企业拓展海外业务的关键环节。本文将系统梳理第一类医疗器械出口销售证明的办理流程、核心要求及注意事项,为相关企业提供清晰指引。
一、办理前的基本认知与资质要求
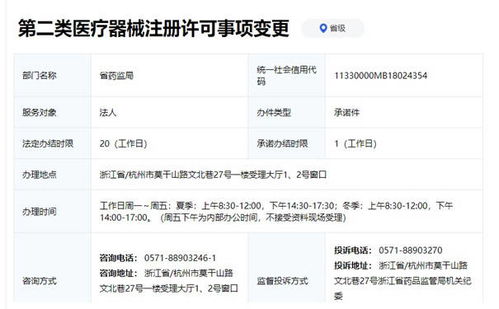
企业需明确产品分类。根据《医疗器械监督管理条例》,第一类医疗器械是指风险程度低,实行常规管理可以保证其安全、有效的医疗器械,通常可通过常规备案管理。企业出口前,必须确保该产品已在国内完成第一类医疗器械备案,并取得备案凭证(备案编号)。这是办理出口销售证明的根本前提。
出口企业主体资质方面,申请人应当是已在国内取得第一类医疗器械生产备案凭证的生产企业,或已进行医疗器械经营的备案人/经营者。
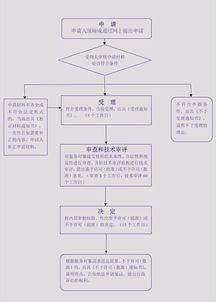
二、核心办理流程(分步骤详解)
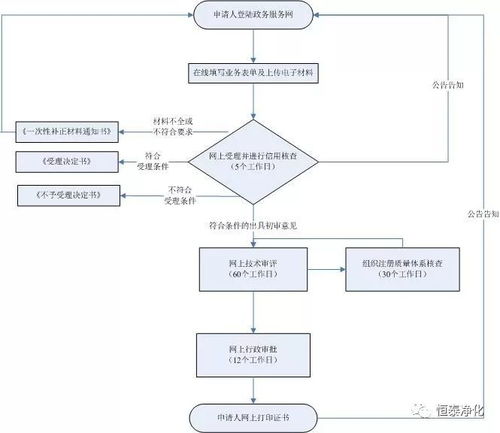
办理流程通常遵循“准备→提交→审核→发证”的线性路径,具体如下:
第一步:材料准备
这是最关键的一步,材料齐全与否直接决定受理效率。所需核心材料清单包括:
- 《医疗器械出口销售证明申请表》:需加盖企业公章,内容填写准确完整。
- 申请企业营业执照副本复印件。
- 第一类医疗器械备案凭证复印件(即国内的备案证明)。
- 产品符合进口国(地区)市场准入要求的声明或证据(如进口国注册/认证文件、符合性声明、客户合同等。若进口国无特别要求,可提交相关声明)。
- 企业自我保证声明:声明所提交材料真实有效,产品符合中国及进口国(地区)相关法规标准。
- 经办人授权证明及身份证复印件。
第二步:提交申请
向企业所在地的省级药品监督管理部门(通常是省、自治区、直辖市药监局)的医疗器械监管相关处室或指定窗口提交书面申请材料。目前,越来越多的省份已开通线上申报系统,企业可优先通过政务服务平台在线提交电子材料。
第三步:主管部门审核
省级药监部门对申请材料的完整性、真实性及合规性进行审核。重点审核内容包括:企业资质是否有效、国内备案状态是否正常、材料是否齐全且盖章有效。对于第一类医疗器械,此环节通常不涉及复杂的专业技术评审。
第四步:核发证明
审核通过后,省级药监部门将为申请企业核发 《医疗器械产品出口销售证明》。该证明文件通常载明:企业名称、地址、产品名称、国内备案凭证号、证明编号、发证机关、发证日期及有效期(通常为2年)等信息。
三、核心要求与注意事项
- 真实性第一原则:所有提交的材料,特别是关于产品合规性的声明,必须真实、准确。提供虚假材料将承担法律责任,并影响企业信誉。
- 主动了解进口国要求:企业有责任自行了解并确保产品满足目的国或地区的法规和标准要求。《出口销售证明》仅证明产品在中国已合法上市,不替代进口国的准入许可。
- 证明文件的有效与管理:《出口销售证明》有效期通常为2年。在有效期内,若企业信息、产品备案信息发生变更,或证明文件遗失损坏,应及时向原发证部门申请变更或补办。
- 产品一致性:实际出口的产品必须与备案凭证及《出口销售证明》上列明的产品信息(如名称、型号规格、结构组成等)完全一致。
- 关注流程优化:密切关注国家及所在地药监部门的最新政策通知,很多地区正在简化流程、缩短办理时限、推行全程电子化,企业应及时适应高效的新模式。
四、常见问题解答(Q&A)
- Q:办理需要多长时间?
A:对于材料齐全、符合要求的第一类医疗器械申请,各省市药监部门通常在5-15个工作日内完成审核发证。具体时限需参照当地办事指南。
- Q:出口销售证明是否就是“通关单”?
A:不是。《医疗器械产品出口销售证明》是药品监督管理部门出具的资质证明文件。货物在海关出口通关时,需根据海关总署要求办理相关手续,两者性质不同。但出口销售证明是海关监管中可能需要核查的重要单证之一。
- Q:产品未在国内备案,可以直接申请出口证明吗?
A:绝对不可以。根据规定,必须先完成国内备案,取得备案凭证后,方可申请出口销售证明。这是强制性要求。
###
为第一类医疗器械办理出口销售证明,是一项规范性较强的行政手续。其核心在于企业自身对国内法规的遵守和对国际市场的合规尽职调查。通过提前充分准备材料、透彻理解流程要求、并保持与主管部门的顺畅沟通,企业可以高效、顺利地取得证明,为产品合法、安全地走向国际市场铺平道路,进而提升我国医疗器械产业的国际竞争力。
如若转载,请注明出处:http://www.tbsaasmall.com/product/19.html
更新时间:2026-02-11 02:35:05