西安办理第二类医疗器械产品注册证及销售企业申请条件详解
在西安从事第二类医疗器械的生产与销售,企业必须严格遵守国家及地方相关法规,分别获取《医疗器械注册证》和《医疗器械经营许可证》。以下是针对在西安办理第二类医疗器械产品注册证以及从事销售活动的企业所需满足的核心申请条件的详细说明。
一、 第二类医疗器械产品注册证申请条件
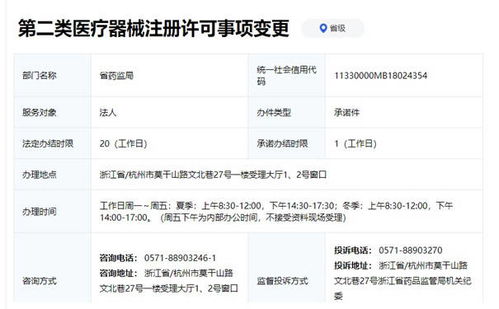
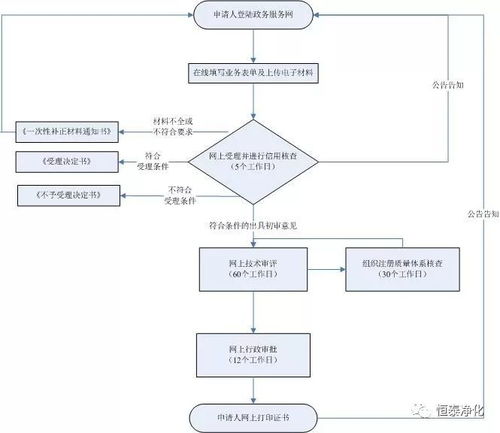
产品注册证是针对医疗器械产品本身的上市许可,由生产企业或注册申请人(如总代)向陕西省药品监督管理局提出申请。主要条件包括:
- 申请主体资格:申请人应为在中华人民共和国境内依法登记的企业,能够独立承担法律责任。境外申请人需指定中国境内的企业法人作为代理人。
- 质量管理体系:申请人必须建立符合《医疗器械生产质量管理规范》(GMP)要求的质量管理体系,并在申请注册前或向省药监局提交体系核查申请,接受现场检查。对于注册人制度下的委托生产,委托方和受托生产企业均需具备相应的质量管理能力。
- 产品技术要求:产品必须已研制完成,其安全性、有效性得到科学验证。申请人需提交详尽的产品技术要求、风险分析报告、产品检验报告(需由具有资质的医疗器械检验机构出具)、临床评价资料(通常为同品种比对或临床试验报告)等全套技术资料。
- 产品检验报告:产品必须通过具有资质的医疗器械检验机构的型式检验,并出具合格的检验报告。
- 说明书与标签:拟定的产品说明书和标签应符合《医疗器械说明书和标签管理规定》的要求。
二、 第二类医疗器械销售(经营)企业申请条件
销售企业需向经营场所所在地的市级市场监督管理局(西安市市场监督管理局)申请《第二类医疗器械经营备案凭证》(注意:经营第二类医疗器械实行备案制,而非许可制,但仍需满足条件并获取凭证)。主要条件包括:
- 企业资质:企业应具有与经营范围和规模相适应的企业法人或非法人企业资格。
- 经营场所与仓储条件:
- 拥有与经营规模和品种相适应的固定经营场所和库房。经营场所和库房不得设在居民住宅内。
- 经营场所和库房的面积、布局、环境(如温湿度控制、避光、防尘等)应能满足所经营医疗器械的储存、展示要求。若经营有特殊储存要求的产品(如体外诊断试剂),需配备冷库等设施。
- 质量管理人员:企业负责人应熟悉医疗器械相关法规。必须配备与经营规模相适应的质量管理人员,如质量负责人。质量负责人应具备医疗器械相关专业(如医学、药学、生物工程等)大专以上学历或中级以上职称,并具有3年以上医疗器械经营质量管理工作经验。
- 质量管理制度:企业应建立覆盖采购、验收、储存、销售、运输、售后服务等环节的完善的质量管理制度,包括质量管理职责、采购与收货、验收、储存与养护、销售与出库、运输与售后服务、不合格品处理、追溯管理、不良事件监测和报告等。
- 计算机信息管理系统:鼓励或要求企业使用符合医疗器械经营质量管理要求的计算机信息管理系统,实现对经营全过程的可追溯管理。
- 售后服务能力:应具备对其所销售产品提供售后服务、技术培训以及协助处理不良事件的能力。
与流程要点
- 分开办理:“产品注册”与“经营备案”是两个独立的监管环节。生产或代理产品需先取得产品注册证;想要销售该产品,企业自身还需办理经营备案。
- 核心区别:注册证关乎产品本身的安全有效,审查重点是技术资料和质量管理体系;经营备案关乎销售企业的规范运营能力,审查重点是场地、人员、制度等经营条件。
- 办理部门:产品注册向陕西省药品监督管理局申报;经营备案向西安市市场监督管理局(或其指定的区级局)提交备案材料。
- 动态合规:取得资质后,企业需持续遵守法规,接受监管部门的监督检查,并履行产品追溯、不良事件监测等义务。
建议企业在正式申请前,详细查阅国家药品监督管理局及陕西省、西安市药监局发布的最新法规文件,或咨询专业服务机构,以确保完全符合所有现行要求。
如若转载,请注明出处:http://www.tbsaasmall.com/product/16.html
更新时间:2026-02-11 20:17:21