深入理解《医疗器械产品出口销售证明管理规定》 聚焦第一类医疗器械的出口销售实务

《医疗器械产品出口销售证明管理规定》(以下简称《规定》)是规范我国医疗器械出口活动、保障产品质量与国际信誉的重要法规文件。对于从事第一类医疗器械(通常为风险程度低,实行常规管理可以保证其安全、有效的医疗器械,如部分外科器械、病床等)出口销售的企业而言,深入学习并准确理解该《规定》具有至关重要的现实意义。
一、 核心目的与适用范围
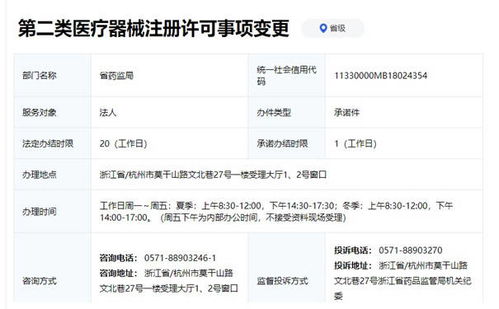
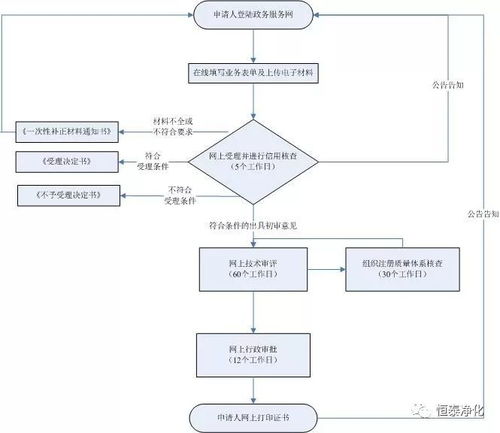
《规定》的核心目的是确保拟出口的医疗器械产品符合我国及进口国(地区)的相关要求,维护“中国制造”医疗器械的国际声誉。它明确适用于所有在中国境内已取得医疗器械产品注册/备案,并拟向境外出口的医疗器械。对于第一类医疗器械而言,由于其在国内实行备案管理(而非注册),企业在申请出口销售证明时,必须确保该产品已完成第一类医疗器械产品备案,并取得合法有效的备案凭证。这是申请出口证明的前提和基础。
二、 申请条件与核心要求(针对第一类医疗器械)
1. 备案有效性:出口企业必须是该第一类医疗器械的备案人,或已获得备案人的合法授权。产品备案信息(如型号规格、预期用途等)必须真实、准确、有效,且备案状态为“有效”。
2. 质量体系要求:尽管第一类医疗器械生产备案要求相对简化,但生产企业仍需建立符合《医疗器械生产质量管理规范》基本要求的质量管理体系,保证产品持续符合强制性标准及备案的产品技术要求。出口企业应能提供相关的符合性声明或证据。
3. 产品合规性:出口产品必须符合中国现行的强制性国家标准或行业标准。如果目标市场有特定法规或标准要求(如CE认证、FDA注册等),企业应自行确保产品符合,但这通常不属于我国出具《医疗器械产品出口销售证明》的直接审查内容。证明文件主要证明该产品在中国境内的合法身份。
三、 证明文件的性质与作用
《医疗器械产品出口销售证明》是一份官方证明文件,而非贸易许可或质量认证。它主要用于:
向进口国监管机构证明,该医疗器械已在中国境内获得合法的上市资格(备案)。
供中国海关办理出口通关手续时使用。
* 作为国际贸易中,证明产品来源及合规基础的重要支持性文件。
对于进口商或国外监管机构而言,这份证明是验证产品中国源头合法性的关键依据之一。
四、 对第一类医疗器械出口企业的实践启示
1. 备案先行,确保源头合法:在开展出口业务前,务必完成第一类医疗器械产品备案和生产备案(如涉及生产),并确保所有备案信息与出口产品完全一致。
2. 动态管理,及时更新:关注备案信息的有效性。若产品备案信息发生变更,需及时办理备案变更手续,确保出口证明申请依据的备案信息始终处于最新有效状态。
3. 理解差异,双重合规:深刻认识到中国备案与目标市场准入要求的差异。取得中国的出口销售证明,不代表自动满足进口国要求。企业需主动研究并满足目标市场的法规,如是否需要CE标志、FDA列名等,实现“双重合规”。
4. 保留记录,应对核查:建立健全的出口产品档案,包括备案凭证、质量标准、检测报告、购销合同、出口证明副本等,以备国内外监管部门的监督检查。
**
对《医疗器械产品出口销售证明管理规定》的学习,对于第一类医疗器械出口企业而言,重点在于厘清 “国内备案”与“出口证明”之间的关系,明确出口证明的证明属性而非许可属性,并牢固树立起从源头备案到最终出口的全流程合规意识**。只有将《规定》的要求内化于日常经营管理中,才能确保出口业务顺畅、稳健,在全球市场上树立负责任的中国医疗器械供应商形象。
如若转载,请注明出处:http://www.tbsaasmall.com/product/11.html
更新时间:2026-02-11 23:21:04